Генетики раскрыли тайну невероятной живучести туберкулеза
Исследователи из ведущих научных центров опубликовали результаты работы, которые дают беспрецедентное представление о том, как бактерия Mycobacterium tuberculosis адаптируется и сопротивляется лечению. Статья, опубликованная в Nature Communications, использует инновационные методы секвенирования ДНК, чтобы выявить ранее скрытые генетические вариации и структурные перестройки, которые помогают возбудителю выживать даже под давлением антибиотиков.
«Более мелкие мутации ДНК давно изучаются, но мы понимали лишь часть истории», — отмечают авторы исследования.
Живучесть бактерии
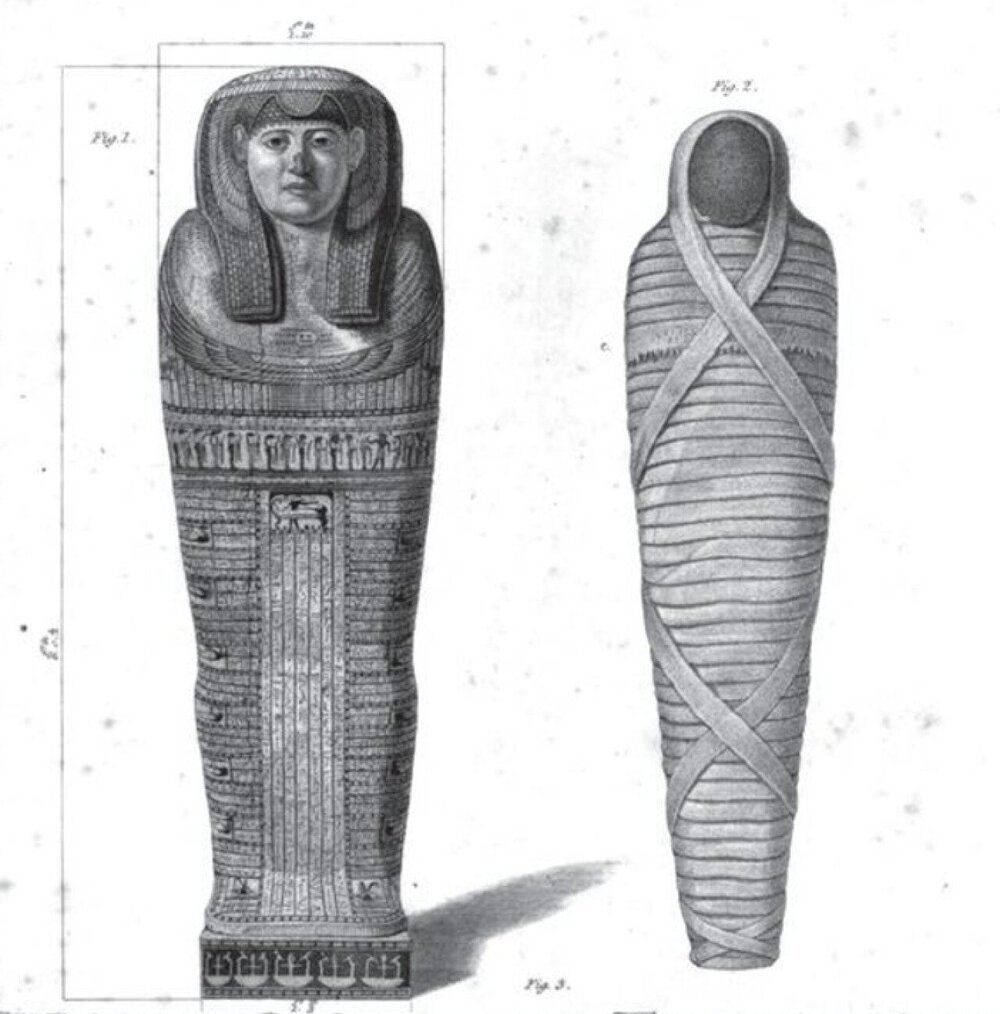
M. tuberculosis демонстрирует уникальную способность выживать в самых неблагоприятных условиях. Ученые отмечают, что бактерия сохраняет жизнеспособность не только внутри человеческого организма, но и в среде с низкой влажностью, экстремальными температурами и даже в условиях долгого времени покоя. Археологические находки, включая мумии древнего Египта, показывают, что признаки туберкулеза можно обнаружить спустя тысячи лет после смерти человека. Скелетные деформации и биологические следы инфекции подтверждают, что бактерия могла сохраняться в костях и тканях в течение веков.
«Невероятная живучесть M. tuberculosis делает ее одной из самых сложных для контроля инфекций бактерий», — объясняют исследователи.
Эти свойства усиливают значимость изучения ее генома, так как структурные перестройки и генетические вариации помогают бактерии не только сопротивляться антибиотикам, но и выдерживать экстремальные внешние условия, что делает ее адаптивность особенно впечатляющей.
От частичных данных к полной карте генома
До сих пор традиционное секвенирование с короткими фрагментами выявляло лишь небольшие изменения ДНК. Эти методы не охватывали повторяющиеся участки, мобильные элементы и крупные перестройки. Использование длинного секвенирования в сочетании с графовым анализом позволило впервые создать пангеном — карту всех возможных генетических вариаций вида, а не отдельных штаммов. Это важно, потому что один штамм может вызвать легкое заболевание, а другой с мутациями или повышенной вирулентностью приведет к тяжелой форме или будет устойчив к лекарствам.
«Теперь мы можем сравнивать полное разнообразие генома, а не ограничиваться точечными изменениями», — подчеркивают исследователи.
Как бактерия меняет геном, чтобы выжить
Длинные прочтения выявили значительные изменения: дупликации, делеции, вставки и инверсии. Многие из них связаны с подвижным элементом IS6110, способным изменять соседние гены. Эти перестройки влияют на количество копий гена или работу регуляторных участков, определяя способность бактерий метаболизировать лекарство или полностью избежать его действия.
Таким образом, бактерия получает альтернативные пути выживания, недоступные при анализе только мелких мутаций. Это объясняет, почему некоторые штаммы ведут себя иначе, чем ожидалось, и почему структурные изменения оказывают долгосрочное влияние на эволюцию устойчивости.
Клинические и эпидемиологические последствия
Понимание этих скрытых изменений открывает новые возможности для диагностики и лечения. Возможность обнаруживать крупные перестройки в клинических образцах позволяет предсказывать, какие штаммы сложнее поддаются терапии и какие могут распространять устойчивые формы.
«Точнее интерпретируя геном, мы сможем назначать пациентам наиболее эффективные комбинации препаратов», — объясняют авторы.
Кроме того, интеграция методов длинного секвенирования и пангеномного анализа в программы эпиднадзора даст более полное представление о динамике распространения туберкулёза и устойчивости к лекарствам. По мере удешевления технологии это становится все более реализуемым для массового использования.
Новый взгляд на борьбу с туберкулезом
Исследование меняет подход к изучению возбудителя, представляя его геном как динамичную систему, способную адаптироваться под давлением отбора. Длиннотекстовое секвенирование и пангеномика позволяют увидеть весь ландшафт изменений, включая ранее «невидимые» участки.
Следующие шаги включают расширение панели изолятов для построения более полного пангенома, интеграцию структурных вариантов в модели прогнозирования устойчивости и исследование их влияния на передачу инфекции. Цель состоит в том, чтобы такой анализ стал частью рутинной геномики туберкулеза, а не узкоспециализированным инструментом.
«Мы можем бороться только с тем, что видим», — подчеркивают авторы.
В конечном счете, раскрытие скрытой биологии M. tuberculosis открывает путь к более точным диагностическим методам, эффективному лечению лекарственно-устойчивых форм и, возможно, борьбе с другими патогенами.
























