Опыты с человекообезьяной. Можно ли скрестить людей и животных?


Что будет, если зародышу макаки-крабоеда добавить человеческих клеток? Родится ли человекообезьяна и возможно ли в принципе появление на свет химеры? Такой эксперимент поставила группа ученых из Китая и США, результаты были опубликованы в научном журнале Cell. Мы решили разобраться в эпатажной теме вместе с экспертом.
На наши вопросы ответил генетик и молекулярный биолог Денис Ребриков, проректор по научной работе РНИМУ им. Пирогова, заведующий лабораторией редактирования генома Научного центра им. Кулакова.
— Денис Владимирович, произошло некое событие в области генетики, о котором СМИ написали так: «Ученые создали химеру — гибрид человека и обезьяны», «Обезьян скрестили с людьми». Как вы сами относитесь к этому событию?
— Это не событие. С точки зрения клеточной биологии это не что-то принципиально новое. Ученые создают гибриды и клеточные химеры уже десятки лет, и здесь нет принципиально новых данных. Вообще, эмбриональные клетки довольно неспецифично узнают друг друга, и на ранних стадиях развития эмбриолог может смешать более-менее кого угодно с кем угодно. И до какого-то момента эта структура будет развиваться как раз по причине того, что у зародышевых клеток почти не работает система распознавания «свой — чужой». У всех клеток взрослого организма есть белковая система, называется «главный комплекс гистосовместимости» (HLA). Благодаря ей даже клетки отдельных организмов внутри одного вида различаются. Например, нельзя трансплантировать органы от одного человека к другому случайным образом, будет отторжение. Мы все знаем, что для трансплантации надо подобрать пару донор — реципиент, чтобы у них совпадали гены HLA. А клетки эмбрионов на ранних этапах развития еще не используют систему HLA. Поэтому эмбриональные клетки легче «дружат» друг с другом, причем до определенного этапа развития — даже клетки разных видов организмов. Так что это не такая уж и новость. Аналогичная работа с эмбрионами мыши и крысы была сделана в 2010 году, а с клетками человека и свиньи — четыре года назад.
— Всем интересно, что именно человеческие клетки внедрили животному…
— Наверное, это оттого, что люди не относят себя к животным. Мы же не животные, мы по образу и подобию… Если ученые сделали, скажем, химеру хомяка и морской свинки — это обычная история, дальше научного журнала не пойдет. А вот когда химера человека с обезьяной, вот это «вау»! А ведь мы генетически даже ближе к макаке, чем хомяк — к морской свинке.
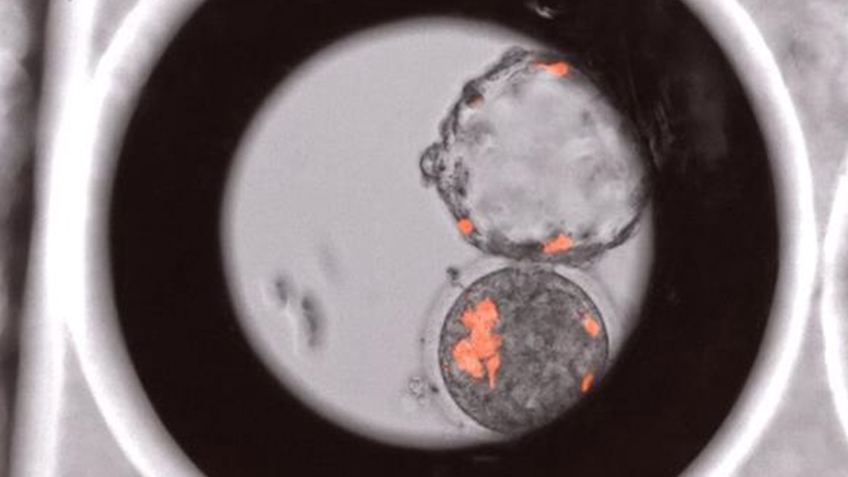
Вот в данном эксперименте исследователи добавили стволовые клетки человека к эмбриону макаки на самом раннем этапе развития (на стадии бластоцисты, это примерно шестой день развития), и несколько дней эти клетки могли развиваться вместе. Но получение взрослого мозаичного организма в результате такой пересадки крайне маловероятно. В природе иногда можно обнаружить клеточный мозаицизм, когда в организме некоторое время присутствуют «чужеродные» клетки (например, клетки плода в организме матери). Но, как правило, даже внутри одного вида такой мозаицизм недолговечен. А в случае межвидовых химер один вид вытесняет другой полностью. В данной статье исследователи как раз наблюдали постепенное снижение содержания клеток человека в эмбрионе макаки. Потому что любая живая система развивается по своей генетической программе, а когда клетки генетически разные, они как бы говорят на разных языках и не могут «договориться» о формировании единого организма. В таком случае либо один тип клеток вытолкнет другой тип, либо все клетки погибнут. В данном случае очевидно, что по мере развития эмбриона макаки все клетки человека постепенно погибнут. И если что-то и родится, то родится обезьяна — без всякого человека.
— Зачем подобные эксперименты нужны науке и что они дают человечеству?
— Воздействуя на живую систему, мы изучаем ее реакцию и по этой реакции понимаем, как она устроена. Например, биологи обожают ломать гены в живых системах и смотреть, что будет. Вот как ребенок крутит будильник и смотрит, когда тот тикает быстрее или когда перестал тикать, так же и ученые «ломают» мышек: берут мышку, ломают ген и смотрят, что будет, живет мышка — не живет.
Некоторые гены очень важные, их выключение приводит к тому, что эмбрион вообще не развивается или развивается до какой-то стадии и погибает. Некоторые гены менее важны — их выключение дает рождающийся организм: мышка рождается, но живет плохо и недолго. А некоторые гены как будто и не влияют ни на что — мышка без них живет нормально. В экспериментах с эмбриональной химеризацией в качестве одной из практических целей исследователи заявляют разработку подходов для получения больших количеств клеток человека для применения в регенеративной медицине. Однако на данном этапе это скорее фундаментальные исследования взаимовлияния клеток и особенностей реализации генетической программы на ранних этапах эмбрионального развития.
И, повторю, в таком эксперименте мы точно не получим «рождение химеры», это будет либо обезьянка, либо человек — в зависимости от того, какая группа клеток победит. У них разные генетические программы, и они точно «не договорятся». Даже несмотря на то, что с обезьянами мы генетически очень похожи, у нас отличается лишь 1% генетической информации (для сравнения — два человека отличаются на 0,1%). Но на уровне межклеточных взаимодействий 1% — это очень много.
Если мы говорим о попытках создания животных, от которых мы могли бы получать органы, — это направление развивается, но оно идет не по пути создания химер на эмбриональном уровне, а по пути замены отдельных факторов в геноме животного на гены человека (так называемые «гуманизированные» животные). Например, в свиньях меняют отдельные гены на гены человека, стремясь сделать так, чтобы внешне клетки животного стали похожи на клетки человека. Тогда можно надеяться, что такой орган мог бы быть воспринят организмом человека при трансплантации как человеческий хотя бы на время.
— Да, недавно была информация о том, как человеческую мышцу вырастили в химерном эмбрионе со свиньей. Но вот что дальше, будет ли это успешно развиваться?
— Пока это все не очень успешно. Насколько я знаю, пока не существует успешных технологий выращивания в животных пригодных для трансплантации человеку органов, и даже более перспективным все-таки выглядит их сборка вне организма, in vitro. Вполне возможно, что 3D-печать органов из отдельных клеток скорее даст нам органы для трансплантации, чем выращивание их в каком-то животном.
— Хотелось бы поговорить про реакцию общества на подобные эксперименты. Такие события в мире генетики, как и все новости о ГМО, вызывают у многих повышенную тревожность. Людям кажется, будто прямо сейчас в лабораториях генетики создают монстров, и даже само слово «химера» как будто несет какую-то угрозу. Закономерны ли такие страхи общества и что вы об этом думаете?
— Общество по природе своей консервативно и просто обязано пугаться всего нового. Это заложено в нашем поведении эволюцией. В популяции есть лишь небольшой процент новаторов (тестовых особей). Если стайке воробьев бросить пшено, то первыми выпрыгнут лишь несколько птичек, на которых популяция проверит: вкусны ли эти зернышки, опасно ли их есть, не поймают ли кого? А когда на тестовых особях проверят «эффективность и безопасность» — подходят и все остальные. Вот как раз по причине такой эволюционно заложенной консервативности общество любые новации воспринимает в штыки. Это нормальная реакция любой популяции: новое — значит неизвестное, неизвестное — значит опасное.

Например, когда появились микроволновые печи, все говорили, что от них будет рак мозга, ни в коем случае не покупайте. Но потом на новаторах проверили: все работает, всем нравится, рак мозга вроде как обычно — и все себе купили. Дальше появились сотовые телефоны, и снова «будет рак мозга, ни в коем случае их не используйте», а теперь они у всех, и даже на рак мозга уже, кажется, начхать, поскольку без смартфона мозг все равно уже не работает. И так с любой новацией. Также будет и с ГМО, просто чуть дольше процесс принятия. Ведь удобство микроволновки или смартфона видно сразу, и люди быстро перебороли страх нового, а преимущества генно-модифицированного продукта для обычного человека не столь очевидны. Хотя ученые и ведут разъяснительную работу о том, что ГМО полезнее и безопаснее «натуральных пестицидов», но на глаз же этого не видно и консервативность побеждает.
Ну и не стоит забывать еще один немаловажный фактор — искусство. Художнику нужно на чем-то сыграть и воздействовать на сознание читателя-зрителя. От Франкенштейна до «Рика и Морти» ученые что-то ужасное непрерывно создают в своих лабораториях. Это работает как яркий образ, и люди на это хорошо откликаются. Люди уже приучены к тому, что да, ученые просто обязаны создавать монстров, а чем же еще заниматься в лаборатории?!
— Тут еще и СМИ подбрасывают дров в костер, пишут: «В Китае создадут человекообезьяну». А если немного пофантазировать и перенестись в далекое будущее, можно ли предположить, что ученые научатся отключать гены, которые отвечают за приживаемость человеческих клеток? Может ли когда-нибудь гипотетически родиться живое существо из человека и животного?
— Как говорил профессор Преображенский: «А зачем?» Вообще, в природе существуют примеры межвидовых гибридов. Например, тигры со львами могут скрещиваться, но их потомки — лигры и тигрольвы — стерильны (самцы, самки при этом иногда могут давать потомство). А что такое вид с генетической точки зрения? Это сообщество организмов, способных при скрещивании давать плодовитое потомство. Примеров, когда разные виды скрещиваются и дают потомство, в природе довольно много, но дальше гибриды, как правило, не размножаются. Это говорит о том, что даже эволюционно близкие и внешне похожие виды генетически изолированы: нельзя просто смешать геномы и получить новый организм. Как я уже сказал, у обезьяны и человека 1% генетических отличий, и крайне сомнительно, что мы сможем совместить клетки со столь разными генетическими программами в один организм.
— Редактировать геном человека пока еще официально не разрешено. Китайский ученый Хэ Цзянькуй, который первым отредактировал гены на стадии эмбрионов, получил три года тюрьмы. Как вы оцениваете успешность его опыта: удалось ли защитить таким образом китайских близняшек Лулу и Нана от ВИЧ-инфекции? Как у них здоровье?
— У обеих этих девочек все в порядке со здоровьем. Но у одной девочки действительно 100-процентное отсутствие белка CCR5 (что теоретически дает защиту от ВИЧ), а у другой получилась мозаичная делеция (CCR5 частично присутствует). Но это не значит, что кто-то из них проблемный ребенок, просто одна из них лучше защищена от ВИЧ, чем другая (больше похожая на исходный тип — кем бы она была вообще без вмешательства). Поскольку эффективность систем CRISPR/Cas для редактирования генома на тот момент была далека от 100%, полученный результат был скорее даже ожидаем.
— То есть какую-то ошибку он допустил в своей технологии редактирования генов?
— Нет, это не ошибка. Ошибка была бы, если бы не в нужном участке ДНК, а в каком-то другом гене были бы какие-то изменения от лишнего разрезания ДНК. А так просто не 100-процентная эффективность. Так бывает: у нас вообще очень мало процессов в биологии бывает со 100-процентной эффективностью.
— В прошлый раз мы говорили о детях с исправленными генами. О том, что готова технология, которая может помочь детям глухих родителей стать слышащими и для этого нужно внести одно изменение в геном самой первой клетки — зиготы. На каком этапе сейчас ваша работа, удалось ли получить разрешение регуляторов и есть ли от них ответ?
— Сейчас основной проблемой для нас, как ни странно, стало практически полное нежелание глухих пар родить слышащего ребенка. Они говорят: «Пусть ребенок будет такой же, как и мы. Зато будет ближе к нам». Вот здесь мы буксуем пока. Что касается разрешения регуляторов, его надо запрашивать под конкретную пару, которая уже вошла в редактирование и для которой мы определим ряд ключевых параметров безопасности процедуры. На сегодня мы и технически, и юридически можем сделать «слышащий» эмбрион, заморозить его, провести все необходимые генетические исследования и затем уже запросить разрешение регулятора для конкретной пары на перенос эмбриона. Но поскольку технология персонализированная (точнее, специфичная для каждой конкретной пары родителей), чтобы запросить разрешение на перенос, нам нужно уже иметь и отредактированный эмбрион, и все доказательства отсутствия нецелевой активности редактора на геноме именно этих родителей. На данном этапе развития технологии геномного редактирования это неизбежно отдельный запрос на разрешение под каждую конкретную пару родителей.
— Вы говорили, что уже нашли несколько пар глухих родителей и они давали согласие. Значит, они отказались?
— Только одна пара дошла до глубокой проработки, мы полностью отсеквенировали их геномы, проверили редактор на соматических клетках. Но на данный момент они второго ребенка пока не планируют, поскольку у них как раз перед обращением к нам родился первенец.
— Глухой ребенок?
— Да. К сожалению, в их случае без починки мутантного гена GJB2 все дети будут с наследственной тугоухостью. Но первому ребенку, насколько я знаю, они уже установили кохлеарный имплант — специальное устройство, позволяющее слышать. Вообще, это очень прогрессивная пара родителей, стремящаяся дать ребенку максимум возможностей.
К сожалению, можно отметить, что такой подход для семей, где оба родителя с тугоухостью, скорее исключение. Гораздо чаще позиция семьи сводится к обозначенной выше: «Не нужна ребенку никакая кохлеарная имплантация, мало ли что случится, а мы его и так всему научим».
— Это какое-то свое мышление и свой мир…. А других случаев, где обоснованно можно применить технологию геномного редактирования. нет? Случаи карликовости не подошли?
— Пар с семейной карликовостью и рецессивным наследованием (когда нельзя выбрать эмбрион в ходе ЭКО и необходимо редактирование) практически нет. Дело в том, что не любая карликовость требует геномного редактирования. Большая часть таких семей может родить обычного ребенка и без геномного редактирования, если у них доминантное наследование заболевания: когда лишь одна из двух хромосом поломана. В таком случае достаточно выбрать эмбрион без поломанной хромосомы — и родится ребенок с обычным фенотипом. Семейных пар с совпадением рецессивных мутаций (когда обе хромосомы поломаны), я думаю, на всю планету единицы.
Все остальные заболевания или еще реже, или хорошо курабельны (как фенилкетонурия или наследственная галактоземия). Вряд ли регулятор одобрит геномное редактирование для неинвалидизирующего или хорошо поддающегося лечению заболевания. Поэтому единственная адекватная ситуация для исправления мутации на уровне зиготы — это наследственная тугоухость.
— Когда, по вашему мнению, разрешат редактировать геном человека на уровне эмбриона, когда появится такое право у ученых?
— Строго говоря, редактировать ученые могут и сегодня, в пробирке и до 14-го дня развития. Но не могут переносить эмбрион женщине, запуская беременность.
— Генная терапия продвигается, появляются новые генные препараты от разных болезней. Например, от спинально-мышечной атрофии (СМА) производится самое дорогое лекарство в мире и люди тоже потихоньку к генной терапии меняют отношение. Как вам кажется?
— Поведение регулятора и реакция общества всегда очень зависят от обстоятельств. Вот, например, коронавирусная инфекция мгновенно ввела в оборот векторные вакцины, которые почти то же самое, что и препараты для лечения моногенных заболеваний у детей (типа СМА). В вирусной оболочке мы вводим в клетки человека ген коронавируса (препарат «Спутник V») или ген человека (препарат «Золгенсма») и заставляем ген нарабатывать новый белок. Многие генетики надеются, что столь массовое применение доставки гетерологично-экспрессируемых генов на основе вирусных векторов в клетки людей in situ приведет к пересмотру отношения регуляторов к доставке генов в клетки человека in situ и одобрению изготовления и применения персонализированных генотерапевтических препаратов на основе вирусной доставки.
В рамках созданных в 2019 году геномных центров мирового уровня сейчас ведется разработка нескольких препаратов для лечения моногенных заболеваний у детей — типа упомянутого вами СМА. Но таких заболеваний известно около 5000, а препараты есть только от четырех. То есть нам надо еще 4996 таких препаратов создать, и без персонализированных векторных подходов и получения разрешения «под пациента» никакая фарминдустрия с таким объемом не справится.
— Очень важные и нужные темы! Над чем еще работаете?
— Исследуем индивидуальный генетический профиль иммунной системы с целью ее регулировки в случае отклонений, анализируем полные геномы детей на носительство моногенных и полигенных заболеваний, продолжаем развивать технологию лечения глухоты для детей глухих пар.



















