Биотехнологи вырастили дрожжи, которые сделают ненужным пальмовое масло
Пальмовое масло и продукты его переработки нынче повсюду — от косметики с бытовой химией до кулинарии с продовольствием. Вред его огромен — не здоровью, как ошибочно полагает обыватель, а природе: вырубаются тропические леса, уничтожаются места обитания редких видов, разоряются местные фермеры.
Новое изобретение поможет снизить потребность в этом ценном сырье, как и в не менее экологически затратном кокосовом масле. Биотехнологический подход, который может лечь в основу более безопасного производства, описан в журнале Nature Chemical Biology.
Молекулярный конвейер с точным контролем
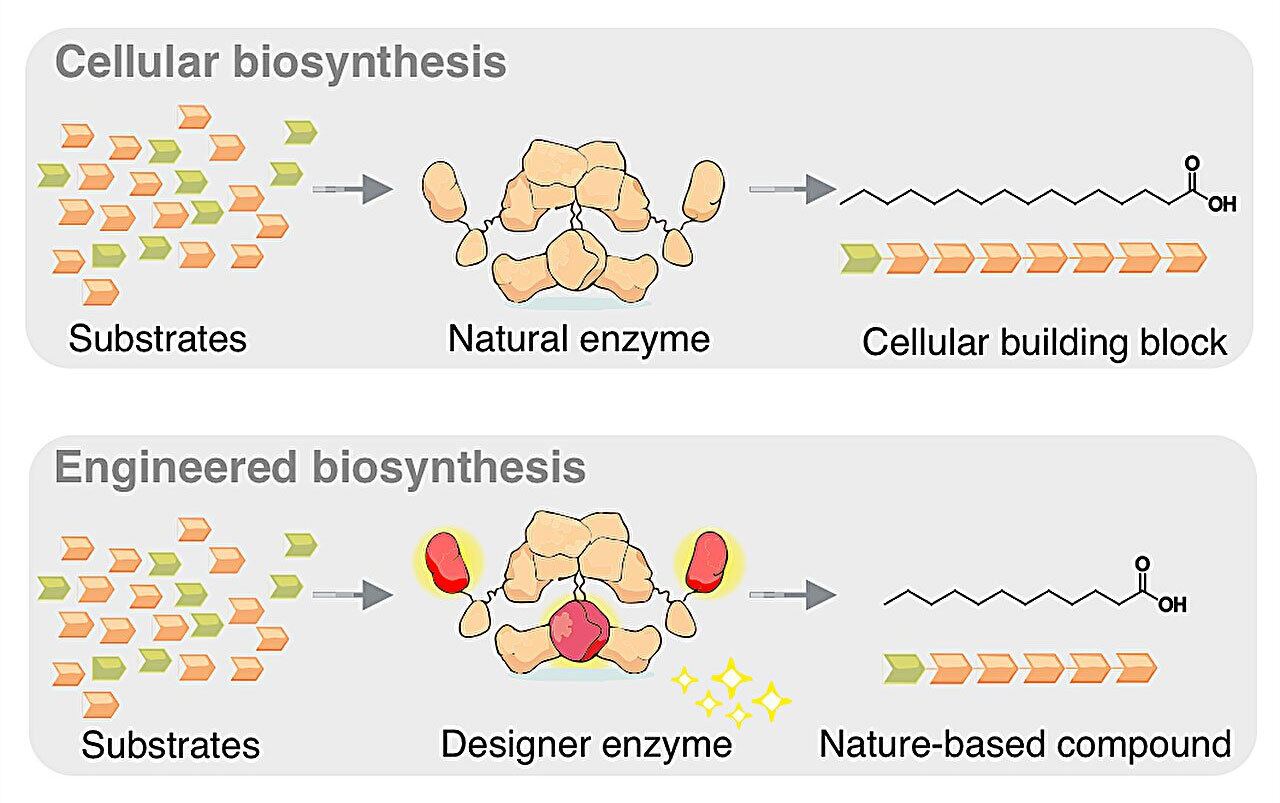
В центре исследования — синтаза жирных кислот (FAS). Этот фермент — своего рода молекулярный конвейер, отвечающий за выработку жирных кислот во всех живых организмах.
«FAS — один из важнейших ферментов клеточного метаболизма, отточенный эволюцией за миллионы лет», — объясняет профессор Мартин Гринингер из Франкфуртского университета имени Гете, руководивший исследованием.
Обычно этот фермент производит 16-углеродную пальмитиновую кислоту, служащую строительным блоком для клеточных мембран и запаса энергии. Промышленности же в основном нужны более короткие варианты с цепью от 6 до 14 атомов углерода, которые сегодня получают из растительных масел.
«Наше принципиальное преимущество — в очень точном контроле длины цепи. Теоретически мы можем получить цепь любой длины, и мы демонстрируем это на примере C12-жирной кислоты, которую иначе можно извлечь только из пальмовых или кокосовых ядер», — говорит Гринингер.
Понять через изменение
Два десятилетия отдали Гринингер и его команда изучению молекулярных основ FAS. Они выяснили, что длина цепи регулируется взаимодействием двух субъединиц: кетосинтаза добавляет два углерода, а тиоэстераза отщепляет готовую цепь в виде жирной кислоты.
«Возникла мысль: можно ли выйти за рамки анализа и создать FAS с новой регуляцией длины цепи? Истинное понимание начинается тогда, когда ты можешь изменить явление или адаптировать его под свои нужды», — убежден профессор.
Две целевые модификации приводят к успеху
Эту идею подхватил докторант Гринингера Дамиан Людиг.
«Мы задались вопросом, что будет, если целенаправленно вмешаться во взаимодействие этих двух субъединиц. Сможем ли мы тогда контролировать длину цепи синтезируемых жирных кислот?» — рассказывает он.
Людиг использовал методы белковой инженерии, позволяющие заменять отдельные аминокислоты или модифицировать целые белковые домены.
«Две модификации FAS методами белковой инженерии в итоге привели нас к цели, — продолжает Людиг. — В субъединице кетосинтазы я сначала заменил одну аминокислоту, что привело к тому, что удлинение цепи за определенный предел стало происходить с низкой эффективностью. Кроме того, я заменил субъединицу тиоэстеразы на похожий белок из бактерий, который проявляет активность в отщеплении коротких цепей».
В зависимости от дальнейших настроек, Людигу удавалось производить коротко- и среднецепочечные жирные кислоты.
Прорывных результатов удалось достичь благодаря сотрудничеству с Даляньским институтом химической физики Китайской академии наук. Лаборатория профессора Чжоу Юнцзиня вырастила штаммы дрожжей с «дизайнерскими» версиями FAS Гринингера, производящие жирные кислоты длиной 12 атомов углерода вместо 16. Обе лаборатории уже подали заявки на патенты на свои технологии.
От жирных кислот к фармацевтике
Тем временем в лаборатории Гринингера пошли еще дальше, исследуя, насколько универсальна платформа FAS для создания целевых биосинтетических путей. Оказалось, фермент можно перенастроить для производства стирилпиронов — предшественников веществ с потенциальным противотревожным эффектом, получаемых из кавы (Piper methysticum).
«Мы систематически изучили, как целые биосинтетические пути можно конструировать на основе FAS из легкодоступных строительных блоков», — поделился Гринингер.
Эти результаты пока не имеют прямого практического применения, но дают важные ориентиры для будущего проектирования новых синтаз.
«Мы продолжим идти этим путем, — заверил исследователь. — Будем использовать этот фермент для создания искусственных биомембран, изучение которых поможет глубже понять ключевые органеллы, такие как эндоплазматический ретикулум и митохондрии».





























